Материалы и процессы черно-белой фотографии
Физико-химические основы фотографии
Глава 5: Черно-белое проявление скрытого изображения5.2. Составные части проявителя и их действиеДействие ускоряющего вещества Проявляющие вещества- слабые электролиты, т. е, кислоты, основания или амфолиты. Вследствие этого в растворе проявляющего вещества его молекулярная форма всегда находится в равновесии с ионной: анионной формой в случае кислых проявляющих веществ и катионной - в случае основных; амфолиты, естественно, диссоциируют и как кислоты, и как основания.Анионы, молекулы и катионы проявляющего вещества обладают разной проявляющей активностью. Так как всякий восстановитель - донор электронов, то из трех форм проявляющего вещества наибольшей активностью, как правило, обладает анионная, меньшей - молекулярная и наименьшей - катионная. Действие ускоряющего вещества основано на том, что оно смещает указанное выше равновесие в сторону увеличения концентрации активной формы проявляющего вещества. Например, гидрохинон, будучи слабой кислотой, диссоциирует следующим образом: 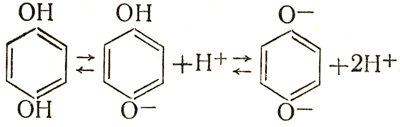 (6.XV) (6.XV)
Из трех форм гидрохинона - молекулярной С6Н4(ОН)2 и ионных C3H4OHO- и С6Н4O2-- - наименее активна первая и наиболее активна третья. Введение в раствор щелочи или соли щелочного металла приводит к снижению концентрации водородных ионов и, следовательно, по закону действия масс к смещению равновесия (6.XV) вправо. Концентрация активной формы гидрохинона повышается, и проявление идет быстрее. Диамины - проявляющие вещества-основания. Практическое применение имеют соли диаминов и аминофенолов, образуемые присоединением молекул кислот к аминогруппам. Соли диаминов - сильные электролиты и диссоциируют нацело, отщепляя анионы - кислотные остатки. Например, парафенилендиамин солянокислый отщепляет ионы хлора 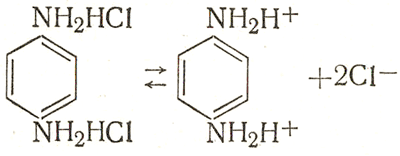 (6.XVI) (6.XVI)
Катион С6Н4(NH3)2++ диссоциирует следующим образом: 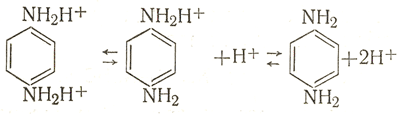 (6.XVII) (6.XVII)
Понятно, что введение щелочи приводит к смещению равновесия (6.XVII) в сторону повышения концентрации молекулярной формы проявляющего вещества, которая служит лучшим донором электронов., чем катионная. Проявляющим веществом-амфолитом является парааминофенол. В растворах он существует в трех формах: молекулярной С6Н4NН2ОН и ионных С6Н4NН2О- и С6Н4ОНNН2Н+. Не рассматривая уравнений диссоциации, укажем, что введение щелочи приводит к повышению концентрации наиболее активной формы парааминофенола - его аниона. Из изложенного ясно, что вещества, повышающие рН раствора, ускоряют процесс. В практике применяют либо едкие щелочи, например КОН или NаОН, либо соли сильных оснований и слабых кислот: соду Nа2СО3, поташ K2СО3, буру Nа2В4О7. Едкие щелочи обеспечивают высокие значения водородного показателя (до значений, близких к 13). Поэтому скорость проявления в растворах, содержащих едкие щелочи, велика. Тем не менее эти ускоряющие вещества без особой необходимости стараются не вводить в проявители. Причина этого станет понятной, если вернуться к общей схеме процесса (6.XII). Из нее видно, что при проявлении образуются ионы водорода. Они нейтрализуют щелочь, а это приводит к замедлению процесса: каждая следующая порция материала требует большего времени проявления, чем предыдущая. Выходом, казалось бы, является введение больших количеств щелочи. Но это практически очень неудобно: раствор разъедает кожу рук работающего, портит одежду и сильно размягчает эмульсионный слой материала, что увеличивает вероятность его повреждений. Соли сильных оснований обеспечивают кислотно-основную буферность раствора при меньших значениях рН, чем щелочи, а следовательно, при умеренных скоростях проявления. В результате такого действия солей продолжительность процесса мало зависит от количества обрабатываемого материала. Буферность проявителя связана с гидролизом ускоряющего вещества. Например, сода (карбонат натоия) дает гидрокарбонат и едкий натр: Na2CO3+H2O Нейтрализация едкого натра бромистоводородной кислотой, образующейся при проявлении, приводит к смещению равновесия (6.XVIII), в результате которого рН раствора остается на прежнем уровне. После того как проходит реакция (6.ХVIII), гидролизу подвергается гидрокарбонат NаНСО3+Н2О с тем же результатом. |
| Назад | Физико-химические основы фотографии | Продолжение |
