Скрытое фотографическое изображение
Физико-химические основы фотографии
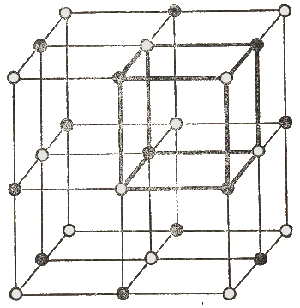
4.1. Строение и свойства эмульсионных микрокристалловПроцессы, идущие в эмульсионном слое под действием света и приводящие к возникновению центров скрытого изображения, связаны, прежде всего, с внутренним строением микрокристаллов и их электрическими свойствами.Всякий кристалл представляет собой систему периодически повторяющихся в пространстве частиц - молекул, атомов или ионов. Кристаллы солей, в том числе галогенидов серебра, ионные - они состоят из ионов. В результате поглощения тепла из окружающей среды частицы находятся в колебательном движении относительно некоторых точек пространства, называемых узлами кристаллической решетки. Расположение узлов, свойственное данному типу кристалла, называется его кристаллической решеткой.
Иодид серебра, в отличие от упомянутых солей, может давать решетки трех типов. Но в эмульсионных слоях встречаются кристаллы только двух модификаций: уAgI имеет кубическую решетку, вAgI - гексагональную. Тип решетки AgI зависит от условий, из которых существенное влияние оказывает ион, находящийся в избытке при кристаллизации, температура, наличие или отсутствие при образовании решетки ионов Br-. При изготовлении негативных эмульсий получают смешанные кристаллы бромида-иодида серебра при условии, что количество иода не превышает известного предела. При больших его концентрациях кристаллы иодида начинают выпадать отдельно. Такая предельная концентрация составляет для уAgI 32 молярных процента, а для вAgI всего лишь 0,1. Смешанные кристаллы имеют деформированную решетку и большее число дефектов, что приводит к возрастанию светочувствительности. Междуузельные расстояния в кристаллах имеют тот же порядок, что и расстояния между атомами в молекулах. Расстояния между ионами в кристаллических решетках галогенидов и атомами некоторых молекул
** Между атомом кислорода и атомом водорода. Ионы в кристаллической решетке упакованы настолько плотно, что электронные оболочки Ag+ и Hal- должны перекрываться. Это видно из сопоставления междуузельных расстояний с ионными радиусами серебра и галогенида: r Ag+=0,113 нм; r Br- = 0,196 нм; r Cl- = 0,181 нм. Ионы связаны не только кулоновскими силами, но и (в меньшей степени) силами Ван-дер-Ваальса. Прочность связи определяется энергией кристаллической решетки. Ее определяют как работу, затрачиваемую на разрушение одного моля вещества кристалла при условии, что его ионы удаляют на бесконечно большие расстояния (практически на такие, где силами взаимного притяжения уже можно пренебречь). Разделив энергию решетки на число ионов, получим среднее значение энергии иона. |
| Назад | Физико-химические основы фотографии | Продолжение |